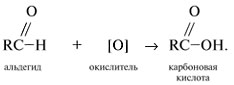
Карбоновые кислоты
Карбоновые кислоты – вещества с общей формулой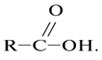
Функциональная группа карбоновых кислот – карбоксильная группа
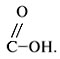
В зависимости от природы радикала R различают предельные, непредельные и ароматические карбоновые кислоты (табл. 12).
Таблица 12
Различные представители
карбоновых кислот
| Одноосновные кислоты | Двухосновные кислоты |
||
|---|---|---|---|
| Предельные | Непредельные | Ароматические | |
| НСООНметановая (муравьиная) кислота |
СН2=СНСООНпропеновая (акриловая) кислота |
кислота |
НООС–СООНэтандиовая (щавелевая) кислота |
| СН3СООНэтановая (уксусная) кислота |
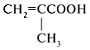 метакриловая метакриловаякислота |
кислота |
НООССН2СООНпропандиовая (малоновая) кислота |
| (СН3)2СНСООНизобутановая кислота |
СН3СН=СНСООНбутен-2-овая (кротоновая) кислота |
кислота |
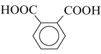 фталевая фталеваякислота |
Таблица 13
Названия карбоновых кислот
как производных углеводородов
как производных углеводородов
| Углеводород | Kарбоновая кислота |
|---|---|
| СН3СН2СН3пропан | СН3СН2СООНпропановая (пропионовая) кислота |
| СН3СН2СН2СН3бутан | СН3СН2СН2СООНбутановая (масляная) кислота |
| СН2=СНСН2СН3бутен-1 | СН2=СНСН2СООНбутен-3-овая кислота |
| СН |
СН кислота |
а) изменение углеродного скелета радикала при карбоксильной группе, например:
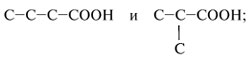
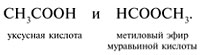
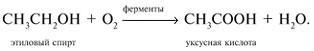
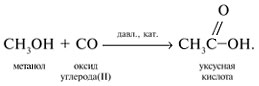
Получение карбоновых кислот
 |
Природные источники карбоновых кислот |
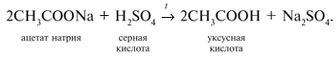

1. По заданным молекулярным формулам составьте структурные формулы линейных карбоновых кислот и дайте им названия: С3Н6О2, С5Н10О2, С4Н6О2, С8Н8О2, С4Н6О4.
2. Запишите структурную формулу изомера лимонной кислоты:
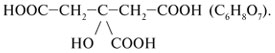
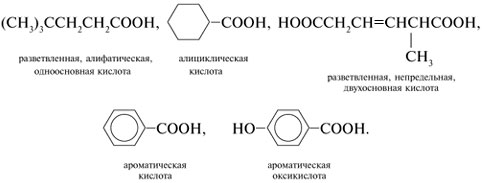
3. Составьте по одной структурной формуле карбоновых кислот разных классов (всего пять), содержащих цикл или имеющих разветвленное строение, с семью атомами С в молекуле. Это могут быть кислоты: а) одноосновные; б) двухосновные; в) предельные; г) непредельные;
д) алифатические; е) ароматические.
4. Приведите структурные формулы карбоновых кислот по их названиям: а) муравьиная кислота; б) бромуксусная кислота; в) п-метоксибензойная кислота; г) изомасляная кислота;
д) щавелевая кислота; е) акриловая кислота; ж) циклопропанкарбоновая кислота.
6. При 110 °С и 454 мм рт. ст. 0,11 г уксусной кислоты (tкип = 118 °С) занимает (в виде пара)
63,7 мл, а при 156 °С и 458 мм рт. ст. 0,081 г занимает объем 66,4 мл. Вычислите молярную массу уксусной кислоты в газовой фазе при каждой температуре. Объясните полученные результаты.
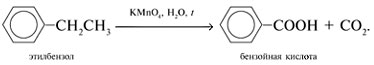
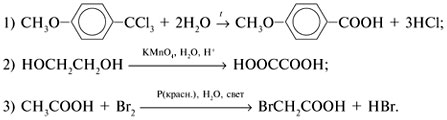
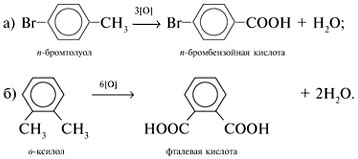
7. Какая карбоновая кислота получится при окислении: а) п-бромтолуола; б) о-ксилола
[1,2-(СН3)2С6Н4]?
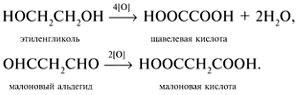
8. Составьте уравнения реакций окисления этиленгликоля НОСН2СН2ОН и малонового альдегида ОНССН2СНО в соответствующие дикарбоновые кислоты.
1. Структурные формулы и названия линейных карбоновых кислот:
С3Н6О2,
СН3СН2СООН
пропионовая
кислота |
С5Н10О2,
СН3(СН2)3СООН
валериановая
кислота |
С4Н6О2, СН3СН2СН2СООНмасляная кислота |
|
С8Н8О2,
С6Н5СН2СООН
фенилуксусная
кислота |
С4Н6О4. НООССН2СН2СООНянтарная кислота |
||
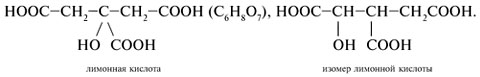
 |
Какой функциональный группы на
рисунке нет в n-гидроксибензойной кислоте:
|
| а) муравьиная кислота;НСООН |
б) бромуксусная кислота;ВrСН2СООН |
в) п-метоксибензойная кислота; |
| г) изомасляная кислота;(СН3)2СНСООН |
д) щавелевая кислота;НООССООН |
е) акриловая кислота;СН2=СНСООН |
| ж)
циклопропанкарбоновая кислота. |
6. Воспользуемся формулой объединенного газового закона:
pV = (m/M)RT
и рассчитаем молярные массы паров уксусной
кислоты при заданных температурах.В указанной формуле R – универсальная газовая постоянная:
R = 8,31 Дж/(моль•К) = 0,082
(л•атм)/(моль•К) = 0,082•760 (л•мм рт. ст.)/(моль•К).
М110° = mRT/(pV) = 0,11•0,082•760•(110 +
273)/(454•0,0637) = 91 г/моль;М156° = 0,081•0,082•760•(156 + 273)/(458•0,0664) = 71 г/моль.
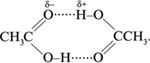
Такой результат (Мэксп > М(СН3СООН) = 60 г/моль) объясняется димеризацией молекул уксусной кислоты вследствие образования межмолекулярных водородных связей (обозначены точками):
7.
8.
Комментариев нет:
Отправить комментарий