Типы реакций и реагентов
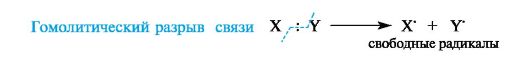
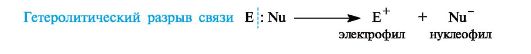
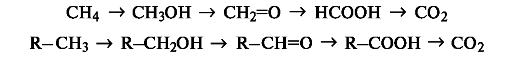
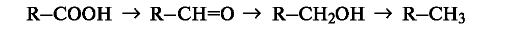
Химические
реакции представляют собой процессы, сопровождающиеся изменением
распределения электронов внешних оболо- чек атомов реагирующих веществ.
Движущей силой химических реакций является стремление к образованию
новых, обладающих меньшей свободной энергией, и, следовательно, более
стабильных систем. В большинстве случаев органические реакции проходят в
виде нескольких последовательных стадий. Детальное описание
совокупности всех стадий химического процесса называют механизмом реакции.
Способность
вещества вступать в ту или иную химическую реакцию и реагировать с
меньшей или большей скоростью называют его реакционной способностью.
Реакционную
способность органического вещества всегда нужно рассматривать только
по отношению к конкретному реакционному партнеру. Само вещество при
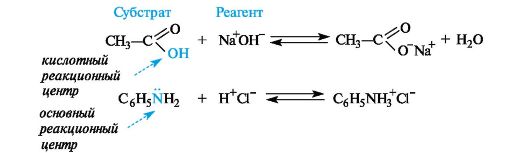
этом называют субстратом, а действующее на него вещество (реакционную частицу) - реагентом. Субстратом, как правило, называют то вещество, в котором у атома углерода происходит разрыв старой и образование новой связи.
В
ходе химической реакции обычно затрагивается не вся молекула, а только
ее реакционный центр, т. е. атом или группа атомов, непосредственно
участвующие в данной реакции.

Органические
реакции классифицируют по типу реагента и характеру изменений связей в
субстрате и в соответствии с направлением (конечным результатом).
Типы реагентов и характер изменения связей в субстрате. Реагенты подразделяют на приведенные ниже основные типы.
Радикальные реагенты (радикалы)
- свободные атомы или частицы с неспаренным электроном. Примеры
радикальных реагентов: гидроксильные НО, гидропероксильные HOO,
алкильные R* радикалы, атомы галогенов СГ, Br*.
Электрофильные реагенты (электрофилы)
- частицы, образующие новую ковалентную связь за счет электронной пары
реакционного партнера. Электрофильные частицы обозначаются символом Е+
или Е. Они могут нести положительный заряд - протон Н+, карбокатионы R3C+, ацилий-катионы R-C=O - или быть электронейтральны- ми, например триоксид серы SO3.
Кислотные реагенты (кислоты) - полностью или частично ионизированные в водных растворах нейтральные молекулы (CH3COOH, HCl) либо положительно заряженные частицы (катионы аммония NH4+, гидроксония H3O+), способные быть донором протона для реакционного партнера.
Нуклеофильные реагенты (нуклеофилы)
- частицы, образующие новую ковалентную связь с реакционным партнером,
предоставляя для этого свою электронную пару. Нуклеофильные частицы
обозначаются символами Nu или Nu и могут быть отрицательно заряженными -
гидрид-ион Н , гидроксид-ион НО , алкоксид-ион RO , карбанион R3C , хлорид-ион Cl - или быть электронейтральными. В этом случае их нуклеофильность обусловлена n- или π-электронами (NH3, H2O, CH2=CH2, C6H6).
Термин «нуклеофил» применяется к частице, реагирующей с любым электрофильным реакционным партнером за исключением протона Н+.
Основные реагенты (основания) - отрицательно заряженные частицы (НО , RO ) или нейтральные молекулы (NH3, H2O), способные оторвать протон от кислотного реакционного центра. Основные реагенты обозначаются символами B- или B.
Окислители - нейтральные молекулы или ионы (O2, Fe3+,
органические восстановители), принимающие электроны или атомы водорода
от органического субстрата; обозначаются символом [O].
Восстановители - нейтральные молекулы или ионы (H2, Fe2+, H-, органические восстановители), отдающие электроны или атомы водорода органическому субстрату; обозначаются символом [H].
В соответствии с характером разрыва связи в субстрате и природой реагента различают реакции радикальные и ионные.
В радикальных, или гомолитических, реакциях (символ R) участвуют радикальные реагенты и происходит гомолитический разрыв ковалентной связи в субстрате. При гомолитическом, или свободнорадикальном, разрыве ковалентной связи (гомолизе) у
каждого из ранее связанных атомов остается по одному электрону. В
результате в качестве промежуточных частиц образуются радикальные
реагенты, как показано ниже для молекулы X-Y (где X и Y обозначают
ковалентно связанные атомы или группы атомов).
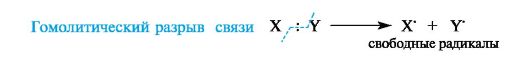
Ионные, или гетеролитические, реакции сопровождаются гетеролитическим разрывом связи в субстрате. При таком разрыве (гетеролизе) ковалентной
связи электронная пара, связывающая атомы, остается с одним из
партнеров по связи. При этом образуются электрофильная и нуклеофильная
частицы.
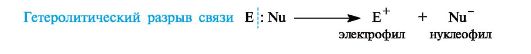
В качестве промежуточных частиц в гетеролитических реакциях принимают участие карбокатионы R3C+ и карбанионы R3C-.
Направление реакции. По направлению (конечному результату) органические реакции делят на несколько основных типов:
• реакции замещения (символ S). Для насыщенных углеводородов характерны процессы радикального замещения SR (см. 3.2.1), для ароматических соединений - реакции электрофильного
замещения SE (см. 3.2.3), для спиртов - реакции нуклеофильного замещения SN у sp3-гибридизованного атома углерода (см. 4.3); для карбоновых кислот - реакции нуклеофильного замещения SN у sp2-гибридизованного атома углерода (см. 6.1.4);
• реакции присоединения (символ
A). Эти реакции типичны для соединений, содержащих кратные связи. Для
ненасыщенных углеводородов характерны реакции электрофильного
присоединения AE (см. 3.2.2), для альдегидов и кетонов - реакции нуклеофильного присоединения AN (см. 5.3);
• реакции отщепления, или элиминирования (символ E). Эти реакции по направлению обратны реакциям присоединения.
Символы реакций и реагентов представляют собой начальные буквы английских терминов: A - addition (присоединение); E - elimination (отщепление); S - substitution (замещение); R - radical (радикал); N - nucleophile (нуклеофил); E - electrophile (электрофил).
• окислительно-восстановительные реакции. Процесс
окисления включает переход электронов от органического субстрата к
реагенту-окислителю, а процесс восстановления - передачу электронов от
реагента к органическому субстрату.
В
органической химии более распространен иной подход к трактовке реакций
окисления и восстановления. Под окислением пони- мают введение атома
кислорода в молекулу субстрата или удаление двух атомов водорода, как,
например, в следующих рядах:
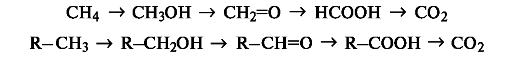
При
таком подходе восстановление представляет собой обратный процесс, т.
е. удаление атома кислорода или введение двух атомов водорода:
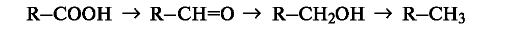
В
окислительно-восстановительных реакциях органических соединений,
безусловно, меняется степень окисления атома углерода, являющегося
реакционным центром. Учет изменения степени окисления, однако, может
потребоваться только при необходимости расстановки коэффициентов в
уравнении реакции. В то же время многие процессы, протекающие с
изменением степени окисления атома углерода, такие, как дегидрирование
(-СН2СН2- -- -СН=СН-) или галогенирование (-СН3 - -СН2О), классифицируются не как реакции окисления.
3.1.2. Факторы, определяющие реакционную способность
Многостадийные
процессы обычно включают стадии образования промежуточных нестабильных
интермедиатов, обладающих высокой реакционной способностью. Во многих
случаях можно предположить образование не одного, а нескольких
интермедиатов. Реакция будет проходить предпочтительно через стадию
образования относительно более устойчивого (обладающего меньшей
энергией) интермедиата. В свою очередь, относительная устойчивость
интермедиатов, часто представляющих собой высокореакционноспособные
промежуточ- ные частицы - свободные радикалы, карбокатионы или
карбанионы, определяется возможностью делокализации электронной
плотности в этих частицах.
Комментариев нет:
Отправить комментарий