Факторы, определяющие реакционную способность

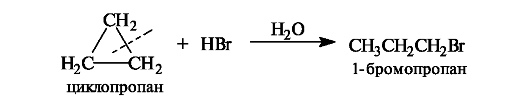
Многостадийные
процессы обычно включают стадии образования промежуточных нестабильных
интермедиатов, обладающих высокой реакционной способностью. Во многих
случаях можно предположить образование не одного, а нескольких
интермедиатов. Реакция будет проходить предпочтительно через стадию
образования относительно более устойчивого (обладающего меньшей
энергией) интермедиата. В свою очередь, относительная устойчивость
интермедиатов, часто представляющих собой высокореакционноспособные
промежуточ- ные частицы - свободные радикалы, карбокатионы или
карбанионы, определяется возможностью делокализации электронной
плотности в этих частицах.
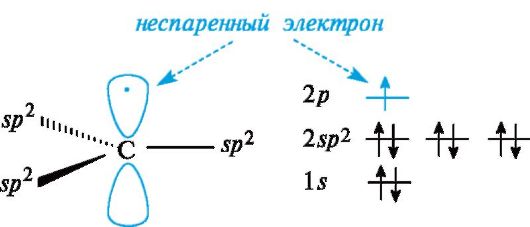
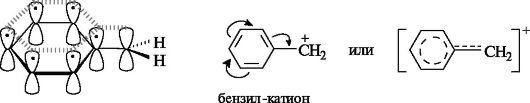
Свободные радикалы. Входящий в состав свободнорадикальных частиц атом углерода с неспаренным электроном находится в состоянии sр2-гибридизации
и три его валентные связи лежат в одной плоскости. Неспаренный
электрон занимает негибридизованную р-АО, расположенную перпендикулярно
плоскости σ-связей (рис. 3.1).

Рис. 3.1. Распределение электронов по орбиталям в свободном радикале
Высокая
реакционная способность свободных радикалов объясняется их стремлением
достроить внешний электронный уровень до устойчивого октета. Алкильные
радикалы - короткоживущие частицы. Их относительная устойчивость
соответствует ряду: третичный > вторичный > первичный.

Это
связывают с энергией разрыва соответствующей связи С-Н, которая
составляет 414 кДж/моль в этане, 396 кДж/моль для группы в пропане и
376 кДж/моль для группы СН в 2-метилпропане.
Стабильность
свободных радикалов существенно возрастает, когда имеется возможность
делокализации неспаренного электрона за счет участия π-электронов
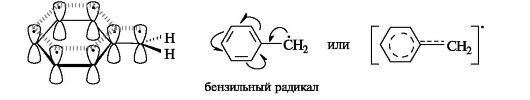
соседней двойной связи или бензольного кольца. Для систем с открытой
цепью сопряжения наиболее типичным примером является аллильный радикал
(см. 2.3.1), а для систем с ароматическим циклом - бензильный радикал
(одноэлектронные смещения обозначены стрелкой с одним острием).

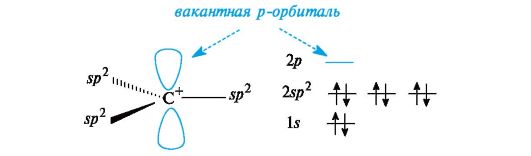
Карбокатионы. К ним принадлежат ионы с положительным зарядом на атоме углерода, обладающем в состоянии sp2-гибридизации
вакантной орбиталью. Три его гибридные орбитали расположены в одной
плоскости, а негибридизованная вакантная орбиталь - перпендикулярно
этой плоскости (рис. 3.2).

Рис. 3.2. Распределение электронов по орбиталям в карбокатионе
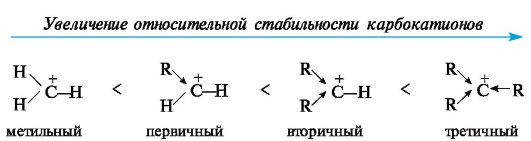
В
алкильных карбокатионах алкильные группы, обладающие +/-эффектом,
способны понижать положительный заряд у соседнего атома углерода. В
связи с этим третичные карбокатионы стабильнее вторичных, а вторичные
стабильнее первичных.
Метильный и
этильный карбокатионы вследствие крайней неустойчивости являются
короткоживущими частицами и их не удается зафиксировать в растворах
существующими методами. Среди простых алкильных карбокатионов наиболее
устойчив трет-бутилкатион (CH3)3C+.

Возможность
делокализации заряда увеличивается, когда положительно заряженный атом
углерода находится в сопряжении с двойной связью. Простейшим примером
такого карбокатиона является рассмотренный выше аллил-катион СН2=СН-СН2+ (см. 2.3.1).
Устойчивость
карбокатионов особенно повышается, если возможно сопряжение вакантной
орбитали атома углерода с π-электронами ароматического кольца.
Например, делокализация положительного заряда в бензил-катионе
обусловливает его высокую относительную стабильность.

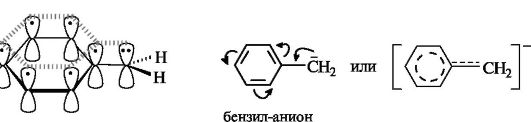
Карбанионы. В
анионах этого типа отрицательно заряжен атом углерода. Простейшие
алкильные карбанионы чрезвычайно реакционноспособны в роли основных или
нуклеофильных частиц.
Более устойчивы по
сравнению с алкильными карбанионы, у которых неподеленная пара
электронов может вступать в сопряжение с двойной связью, находящейся в
соседнем положении по отношению к карбанионному центру. Примерами
служат карбанионы аллильного СН2=СН-СН2 (см. 2.3.1) и бензильного типов. В том и другом случае осуществляется ρ,π-сопряжение.

3.2. Наиболее важные реакции углеводородов
Углеводороды
имеют наиболее простой состав среди органических соединений.
Реакционная способность углеводородов зависит от степени их
насыщенности. Для них наиболее характерны следующие реакции:
• для насыщенных - реакции радикального замещения Sr;
• для ненасыщенных - реакции электрофильного присоединения АЕ;
• для ароматических - реакции электрофильного замещения SE Эти же реакции свойственны производным углеводородов, т. е.
соединениям других классов, содержащим углеводородные фрагменты указанных типов.
3.2.1. Реакционная способность насыщенных углеводородов
В насыщенных углеводородах - алканах и циклоалканах - имеются только sp3-гибридизованные
атомы углерода. Представители алканов и циклоалканов приведены в табл.
3.1. Для этих углеводородов характерны неполярные Csn3-Csn3 и практически неполярные Csp3-H σ-связи,
sp sp sp
обладающие достаточной прочностью (см. табл. 2.1), что объясняет инертность алканов в большинстве гетеролитических реакций.
Алканам свойственны радикальные реакции замещения SR. Аналогично ведут себя обычные циклоалканы, содержащие 5-7 атомов углерода в цикле.
Циклопропан
по реакционной способности напоминает ненасыщенные соединения. Так, он
реагирует с галогеноводородами с расщеплением трехчленного цикла.
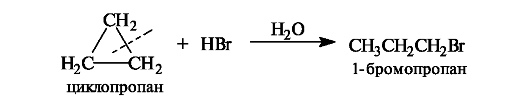
Циклобутан гораздо устойчивее циклопропана, но и для него известны реакции с раскрытием цикла.
Комментариев нет:
Отправить комментарий